治験に関わる機関
治験は、製薬会社の依頼により医療機関で行われますが、製薬会社にかわって開発業務を行うCROや、医療機関の治験業務を支援するSMO、第三者的な立場から治験を審査するIRB等、様々な機関が係りながら進められていきます。
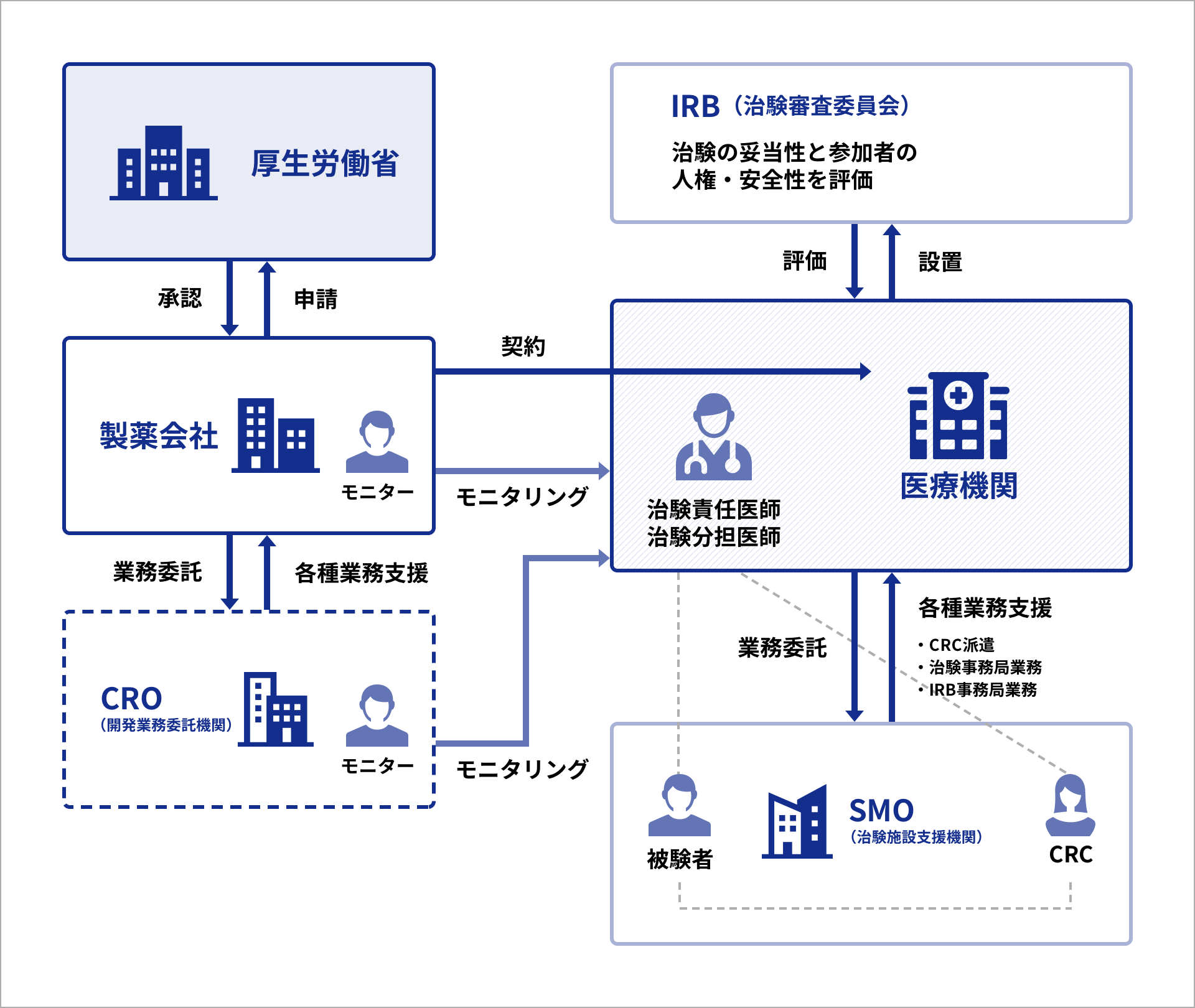
※CRO(Contract Research Organization:医薬品開発業務受託機関)...製薬メーカーが行う医薬品開発のさまざまな業務を受託する組織
※IRB(Institutional Review Board:治験審査委員会)...被験者の人権や治験の妥当性を審議するための、医学・薬学等の専門家で組織する独立した委員会
そこで国際化を視野に入れた教育システムの構築や新たな課題への提言、国際的評価を得るための研究など、独自のアプローチを行っています。質の高い臨床試験を円滑に実施するために欠かせないSMO。医療は日々進歩を続けます。より倫理的で、より科学的な臨床試験実現を目指して。日本SMO協会は、時代のニーズに明確に応えていきます。
SMOとは?
SMO(Site Management Organization:治験施設支援機関)は治験実施施設(医療機関)と契約し、GCPに基づき適正で円滑な治験が実施できるよう、医療機関において煩雑な治験業務を支援する組織です。
治験に関わる医師や看護師、事務局の業務を支援することにより、スタッフの負担を軽減し、治験の品質・スピード向上を支援します。
【SMOの主な業務】
- 医療機関での治験を開始するための補助
- 施設SOPの作成・提供
- GCP対応書式の提供
- 治験責任医師/分担医師、治験協力者の教育
- 医療機関での治験を実施するための補助
- 治験事務局の立ち上げ
- 治験事務局の運営補助
- 治験事務局の教育
- IRBの設立・運営の補助
- IRBのSOPの作成・提供
- IRB委員、IRB事務局の教育
- IRBの運営補助
- IRB事務局補助(議事録、審査結果報告書などの作成)
- CRC(治験コーディネーター)の教育と派遣
- CRCの教育研修
- CRC業務のフォロー
- バックアップ体制の確保
SMOの生い立ち
治験はGCPという世界共通の基準に沿って行われますが、平成10年4月、日本ではより厳格な治験を実施するするための法律「医薬品の臨床試験の実施の基準に関する省令」(新GCP)が施行され、治験を行なう際の基準が大変厳しくなりました。
これにより、治験が行われる医療機関での書類の整備・管理や、手続きが複雑になり、国内ではなく海外で治験をおこなうという「治験の空洞化現象」が見られるようになりました。
こうした中、治験が円滑に進むように治験を実施する医療機関の外部支援機関としてSMOが誕生し、平成15年7月の改正GCP省令において、SMO業務が法令上、正式に認められました。
厚生労働省
「医薬品の臨床試験の実施の基準の運用について」(平成18年9月)より「治験施設支援機関」について
治験の実施に係る業務の一部を実施医療機関から受託する者は、治験施設支援機関(SMO:Site Management Organization)とも呼ばれる。
厚生労働省
「SMOの利用に関する標準指針策定検討会報告書」(平成14年11月)よりSMOの定義
- SMOは、実施医療機関がその事務機能等を委託する機関であり、「治験の実施に係る業務の一部を実施医療機関から受託又は代行する者」とすることが適当である。
- SMO(Site Management Organization)の日本語訳としては、「治験施設支援機関」とすることが適当である。
